流れ 2016年2月号 目次
― 特集テーマ:流体工学部門講演会 ―
| リンク一覧にもどる | |
塞栓後脳動脈瘤の再開通発生に関するCFD解析による研究
藤村 宗一郎
|
1.はじめに
平成27年11月に東京理科大学にて開催された第93期日本機械学会流体工学部門講演会において発表した研究に関して,光栄にも優秀講演表彰を受賞すると同時に,本ニュースレターへの記事投稿の機会を頂いた.選考委員会の先生方,及び日本機械学会の方々にはこの場を借りて御礼を申し上げる.ここでは研究内容である再開通した脳動脈瘤に対するCFD解析に関して紹介させて頂く.
2.脳動脈瘤の再開通
日本人の主な死因の1つである脳血管疾患に脳動脈瘤と呼ばれる,脳血管の一部が膨らむ病気が存在する(図1参照).基本的に脳動脈瘤を有することによる自覚症状はないが,万が一脳動脈瘤が破裂した場合,くも膜下出血となる.くも膜下出血は発症者の約3割がその場で亡くなる非常に危険な病気であるため(1),脳動脈瘤が未破裂の状態で発見された場合には外科的な手法で処置されることが検討される.
近年,未破裂脳動脈瘤の治療には,コイル塞栓術が広く行われており適応症例数が増加している.コイル塞栓術では,カテーテルと呼ばれる医療用の細い管を患者の足の付根(鼠蹊部)より挿入し,脳動脈瘤内にプラチナ製のコイル(ワイヤー様のもの)を留置する.留置したコイルが脳動脈瘤内の血流速度を低減させ,血栓化させることで血液侵入を抑制し,破裂を防ぐ(2).コイル塞栓術は,頭部開頭を行うクリッピング術と比較して低侵襲で,患者への身体的負担が少ないというメリットがある(3).一方で,留置したコイルが血流により脳動脈瘤内で圧縮され小さくなるコイルコンパクション等によって瘤内へと再び血液が流れ込む,再開通(Recanalization)と呼ばれる現象が発生することがある(図2 参照).再開通はコイル塞栓術という術式が故に発生し得る現象として問題となっており(4),万が一これが発生すると,脳動脈瘤の破裂リスクが再び高まるため再手術を余儀なくされる場合がある(5 - 7).再手術は患者への身体的・精神的・経済的負担を高める.臨床的には,コイル塞栓術を施術した脳動脈瘤の内,10~25%で再開通を認めた報告がある(5, 8, 9)が,現在のところ再開通発生の正確なメカニズムは解明されていない.現状,手術時においては医師の主観的判断によりコイル充填方法や挿入するコイルの種類が決定されており,客観的な判断基準がないため,その確立が求められている.
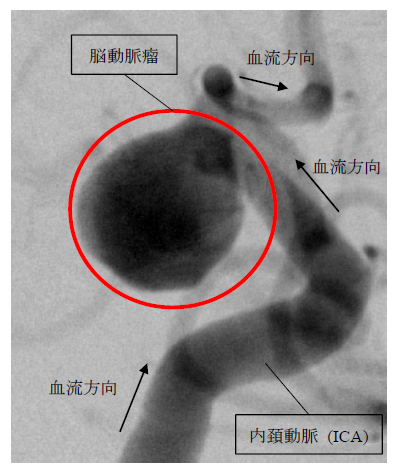
Fig. 1 Saccular Aneurysm
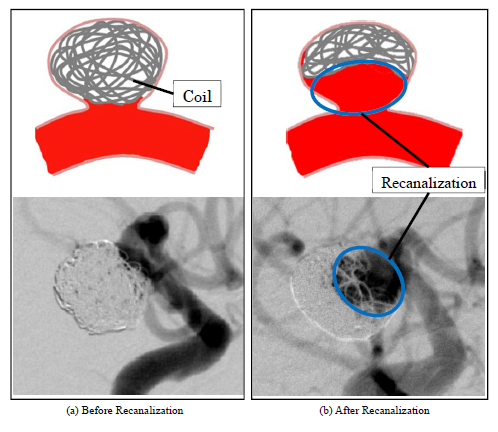
Fig. 2 Illustration and Angiographic images of recanalized aneurysm
3.血流解析と統計学的解析の手法
本研究では,臨床現場で実際に撮影されたデジタル・サブトラクション血管造影法 (DSA: Digital Subtraction Angiography)による血管造影画像,及びコイルの画像を用いることで,血管系における流れを数値流体力学により再現した.DSAにより撮影されたスライス画像を立体的に再構成し,解析に不要な細かい血管のトリミングや表面のスムージング等を施すことで,流体解析に必要な3次元形状データを得る.計算格子は非構造格子を用い,境界層による速度勾配の影響を考慮するため,壁近傍に7層のプリズムメッシュを,その他の領域にテトラメッシュを配置した.代表長さを血管径,代表速度を内頚動脈における断面平均速度としたときのレイノルズ数は約500であり,流れ場は三次元非圧縮性層流場として扱った(10).血液は密度ρ = 1,100 kg/m3,粘性係数μ = 0.0036 Pa・sのニュートン流体,血管壁とコイルを剛体のすべりなし条件として仮定した.また,流入境界条件には健康な成人の平均流量(10)を基にした拍動を質量流量として与え,出口端面を静圧平均0Paとした.計算領域は,流入流出境界条件による流れ場への影響を防ぐため,入口,出口端面を共に75mm延長した.各症例に対して,コイル塞栓術前とコイル塞栓術後の形状に対し血流解析を行う(図3参照).
本研究では,以上の条件下における,「再開通症例」及び「再開通していない症例」の血流解析を行った.「再開通症例」は1回目の塞栓術後1年間の経過観察中に再開通が発生し,再手術適応となった症例とした.他方,「再開通していない症例」は経過観察中に再開通が発生しなかった症例とした.本報では,再開通症例群と再開通していない症例群における流れ場の比較を統計学的手法による検定を用い行った.検定を行うパラメータの数値分布が正規性に従う場合かつ等分散を仮定できる場合にはスチューデントのt検定,等分散を仮定できない場合にはウェルチのt検定を使用し,分布が正規性に従わない場合にはマン・ホイットニのU検定を行った.共にP値が0.05以下である場合を有意差ありとして判定し,有意差が認められたものについてはROC解析(Receiver Operating Characteristic Analysis)を行った.ROC解析とは検定結果を差別化するための手法のひとつであり,検査結果を陽性か陰性かに分類する際の最適な特定の値を求めるものである.
Fig. 3 Analysis Flow
4.CFD解析の結果と臨床への活用
図4に再開通症例に対する解析結果の一例を掲載する.それぞれ,(a)術前の脳動脈瘤における流線,(b)術後のコイルを詰めた脳動脈瘤における流線,(c)術後のコイル表面に負荷される圧力,(d)コイル塞栓術直後のコイル形状,(e)経過観察後のコイル形状である.これらより,インフロー付近においてコイル表面の圧力が高くなっていることが確認できる.脳動脈瘤内へと流れこむ血流を妨げている為に見られる現象であると考えられ,この高圧力域を起点としたコイルコンパクションの発生が定性的に確認できる.
この結果より,血行動態学的要因である圧力と臨床的要因であるVER: Volume Embolization Ratioに関する新たなパラメータを定義し,再開通症例群と再開通していない症例群との間で比較を行ったところ,統計学的に有意な差があった.尚,VERは治療を行う脳動脈瘤に対してどれだけのコイルを挿入したかを表す無次元数であり,手術中でも観測可能な指標の1つである.式を以下に表す.
![]()
また,統計学的に有意差が見られたパラメータについてROC解析を行うことで再開通症例と再開通していない症例との間に,これらを分類するための数値的な線引きを行うことが可能であった.特に,線引きされた値はカットオフ値と呼ばれ,この値を基準として脳動脈瘤が再開通するのか,再開通しないのかを二極分類することが可能である.
上記結果より,CFD解析による結果を用いて各症例における“再開通しないためのVER値”を求められる可能性がある.基本的に,VERの値が高いほど再開通のリスクは低減すると言われているが,VERを高めようとして無理にコイルを詰め過ぎると術中破裂の危険性が増し,その分の費用も増加する(コイル1本分の価格は約十数万円であり,小さな脳動脈瘤に対しては数本,大きい脳動脈瘤には数十本ものコイルを挿入することもある).先行研究ではVERと再開通との関係を後ろ向きに調査したものが複数存在するが,至適値は20~36%とばらつきが見られ(11-13),一定の見解は得られていない.これは,脳動脈瘤個別の血行動態を考慮に入れていないことが原因であると思われる.実際,Babikerら(14)は同じVERであっても脳動脈瘤の形状により血流抑制効果が異なることを示している.
これら先行研究とは異なり,本研究においては,各脳動脈瘤個別の血行動態を考慮に入れたVERの値を算出することが可能である.つまり,コイル塞栓術を行う前の脳動脈瘤に対して血流解析を行い,解析結果とROC解析により求められたカットオフ値を利用することで,その脳動脈瘤が再開通しない為に必要なVERの値を求めることが可能となる.今後,解析症例数を更に増やすことで,再開通する脳動脈瘤と流体力学的要素,VERとの間に一定の関係を導くことができれば,将来的には,術前の血流解析による手術計画の施行により,再開通のリスクを低減させたり,予測が可能となる.
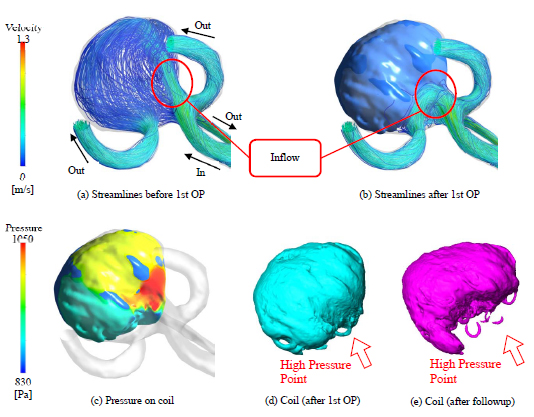
Fig. 4 Result of Recanalized Case
5.おわりに
近年,脳血管系における様々な血流解析が頻繁に行われるようになってきたが,その多くは基礎研究にとどまっており,実際の臨床へと応用されていないのが現状である.本研究では脳動脈瘤の再開通という,コイル塞栓術時における最も大きな問題点の一つを取り上げ,その発生要因と臨床への応用方法についての可能性を検討した.現在の手術で活用されている指標であるVERに焦点を当て,さらに数値流体力学による血流解析と組み合わせることでこの値を臨床へ活用するものである.
再開通発生のリスク低減は,患者,医師の双方に大きなメリットをもたらす.今後,解析症例数をより一層増加させていくことで,脳動脈瘤の再開通発生リスクを考慮した患者個別の治療計画の立案が期待できる.
謝辞
末筆になりましたが,学会当日の会場においてご聴講,貴重なご意見を頂きました皆様,選考委員会の皆様,並びに今回のニュースレターへの投稿機会を与えて下さいました日本機械学会流体工学部門の皆様に感謝申し上げます.加えまして,共同研究先である東京慈恵会医科大学 脳神経外科の皆様にはここに深く感謝の意を申し上げます.
文献


