流れ 2019年2月号 目次
― 特集テーマ:JSME年次大会特集 ―
| リンク一覧にもどる | |
多機能OCTによる毛細血管血流速マイクロ断層可視化法
佐伯 壮一 |
1.はじめに
加齢や紫外線照射によって進行するシワや肌の弛みなどの皮膚の老化現象は,皮膚組織における代謝機能の低下に関連しており,組織や細胞への組織液の循環システムは,スキンケアやアンチエイジングの重要な評価指針である.皮膚組織は表皮・真皮・皮下組織の主に3層から構成され,毛細血管は表皮直下の乳頭層から真皮上層の乳頭下層に掛けて走行している.微小血流動や組織液の流動特性は,代謝機能と共に皮膚粘弾性特性をも変化させうるため,シワ発生などのスキンメカニクスの解明には微小循環血流を非侵襲に定量計測する必要がある.Optical Coherence Tomography (OCT)は,5 μm程度の空間分解能にて生体組織内部の形態分布をマイクロスケールで非侵襲in vivo断層可視化している[1].更にOCT干渉信号からドップラー変調量を解析し,赤血球などの流動を可視化するDoppler OCTが開発されているが,毛細血管血流速の定量評価には至っていない[2].本研究では,OCT干渉信号における位相変化を検出する隣接自己相関法およびノイズ除去アルゴリズムを導入し,高精度にドップラー変調量を断層計測するOptical Coherence Doppler Velocigraphy (OCDV) を構築し,皮膚表層部の形態分布と3次元毛細血配向および流速分布のマイクロ断層可視化を行う.
2.Optical Coherence Doppler Velocigraphy(OCDV)
本システムは,低コヒーレンス干渉計(Time-Domain OCT)[3]に基づいている.光源には,中心波長1317 nm,半値幅100 nmのSLD広帯域光源を用いた.参照アーム側の光学系システムには高速光路走査と分散補償を可能とするRSODシステム[4]を導入し,12kHzにて奥行き方向の干渉信号を断層検出する.対物アーム側には,2軸ガルバノミラーを用いて照射ビームを2次元走査し3次元可視化(奥行き分解能7.5μm,横分解能10μm)を可能としている.得られた干渉信号に対しOCDVアルゴリズム[5]を適用し,血流速マイクロ断層可視化実験を行った.これは,干渉信号に対しヒルベルト変換を施し解析信号を求め,隣接する干渉信号に対し自己相関を施し,流動すなわち赤血球の移動によって発生するドップラー変調量を位相差として求め,位相差から赤血球の流速分布を定量的に断層検出する手法である.実際には,同一軸の奥行き方向の干渉信号を6本取得しドップラー変調量の断層信号を得ると共に,これを対物アームにて2次元走査して3次元血流速断層像を検出した.
3.実験結果(適用例)
OCDVシステムを麻酔下におけるマウスの耳皮膚に適用し,3次元OCT断層像(形態分布)(図1)と血流速分布(図2)をマイクロスケールにて断層可視化した.血流速分布は耳表面から165μm深部の水平断面を断層表示したものであり,耳末端に向けて右下から左上へと血管径φ50μm程度の細動脈血管が配向しており,さらに細い血管が所々に分岐して存在しているのが観察できる.また,耳末端の辺縁部には非常に細い毛細血管が分布していることも確認できる.3次元OCT断層像から細動脈クラスの血管配向角をマニュアルにて算出し,血管軸方向流速値をドップラー変調量から変換して求めカラーマップ表示している.耳皮膚細動脈における血流速は4~8 mm/sec程度であり,血管中心にて流速値が大きいことが確認できる.これらの血流速値は,マウス腸間膜のマイクロPIV血流速可視化報告[6]と同程度であり,血流速のマイクロ断層可視化についての妥当性が期待できる.
皮膚における微小血管の血流速計測手法としては,マイクロスコープやレーザードップラー流速計などが知られている.しかし,これらの手法は生体組織の散乱特性に非常に弱く,100μmを超える深部検出は困難である.また,マイクロスケールにて断層可視化する能力も持ち合わせていないことから,血管3次元構造(血管網)を考慮した微小循環の血流速をin vivo 断層検出する医療用モダリティーはOCTだけが持ち合わせているポテンシャルと考えている.毛細血管における血流動態は炎症疾患や癌をはじめ,疾病における最も重要なキーファクターであり,美容領域におけるシワやシミに対してもスキンメカニクスを介して作用していることが示唆されている.本開発システムは表皮直下における毛細血管血流速をin vivoマイクロ断層可視化診断する有効性が示唆され,微小血管の形態や機能に加え,リンパ流も含めた薬効動態の評価も可能とするため,疾病や美容トラブルなどを診断する重要な指標になりうると期待している.
4.おわりに
本研究では構築システムによって,生体組織の組織形態分布および毛細血管血流速分布を3次元マイクロ断層可視化できることを確認した.従来のOCT技術は表皮厚などの形態分布観察に使用されてきたが,本システムでは,従来のOCT技術に抹消血管の血流速をマイクロ断層可視化する機能を付与することによって新たな有用性を示した.OCTを多機能化する検討は近年進んできており,生体組織の粘弾性挙動の空間分布を診断できることも示されている[7, 8, 9].近年注目されている再生医療においても,移植治癒に不可欠な再生組織の非接触力学的品質保証に多機能OCTの利用も検討が始まっている[10].今後,OCT技術の更なる多機能化により,他分野への貢献が期待される.

Fig. 1 3-dimensional morphological image of a mouse ear obtained by OCDV.
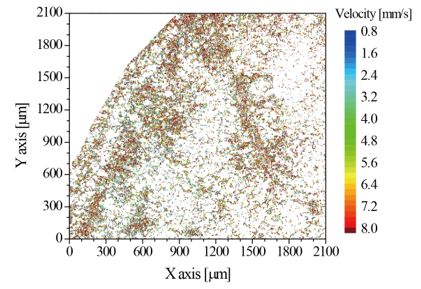
Fig. 2 2-dimensional en face tomographic visualization of capillary blood velocity of a mouse ear obtained by OCDV.
参考文献



