流体力学に基づく脳動脈治療用カバードステントの塞栓性能の定量評価と設計最適化
 田地川 勉 関西大学 システム理工学部 |
 西 正吾 札幌東徳洲会病院 脳神経外科 |
 中山 泰秀 国立循環器病研究センター 生体医工学部 医工学材料研究室 |
Quantitative evaluation and design optimization for stent embolization of newly developing micro-porous covered stent for cerebral aneurysm treatment
|
||
1. はじめに
現在国立循環器病研究センターでは,未破裂脳動脈瘤(1)の新しい治療デバイスとして,図1に示すようなカバードステントを開発中である.本デバイスの開発・実用化は,2011年度から始まった厚生労働省のプロジェクト「早期・探索的臨床試験拠点整備事業」において,全国で採択された5 施設中で唯一医療機器を取り扱う同センターで,医師主導治験をめざすシーズの1 つに選定されている(2).このため,より効率的な開発・実用化のために,論理に裏付けられた仕様決定と設計最適化が求められている.

図1 プロトタイプのカバードステント
そこで我々は,流体力学に基づき,実際の治療時に脳血管内で起きる現象をできるだけ本質だけを抽出し,単純・要素化された実験と理論によってその治療効果を評価・予測する試みを行い,さらに設計最適化を行った(3).実験や新たに構築した理論解析の詳細については,既報で十分に詳説済みである事から,開発中のカバードステントの特徴と最適化の概要,およびその後の動物実験による評価結果に重きをおいて紹介させて頂く.
2. 多孔薄膜カバードステント
2.1 開発の経緯
本カバードステントは,図1のように金属製ステントストラットを厚さ20~30µm程度ポリウレタンフィルムで覆っており,フィルムに直径数十~数百µmの円孔をエキシマレーザで多数搾孔することで多孔化している.本ステントを図2に示すように,動脈瘤直下の血管(親血管と呼ぶ)に僅か1つ留置することで,親血管から動脈瘤に流れ込む血流が遮断され,血流停滞を起因とする血栓を瘤内に形成させることで,ステント留置直後に塞栓治療できる.最終的に瘤内の血栓は周囲の組織と置き換わり結合組織化するため,再発する危険性はほとんど無く瘤は自然に縮退する.
図2 動脈瘤モデルへのカバードステント留置実験時のX線造影画像
これまで本カバードステントと同様のデバイスが開発されている(4)が,単純にステント全体をフィルムで覆うと瘤と親血管の接続部(ネック部と呼ぶ)を確実にフタできるが,フィルムが血流と接する部分で血栓が形成される危険性が極めて高く,またステントを留置した親血管が肥厚・狭窄する可能性が高いため安全な治療法とは言い難い.
そこで,本カバードステントでは共著者らの小口径人工血管開発の経験を生かし,留置後のステント内腔面を早期に「血管再生」させることで問題解決することを考えた.具体的には,カバードステントに多数の微細孔を設け,親血管表面の内皮細胞がフィルムの微細孔を介して容易に交通できるようにし,ステント内腔面を早期に内皮細胞で埋め尽くすことで,過剰な新生内膜形成や血栓形成・付着による血管の肥厚や狭窄の抑制を狙っている(5).
2.2 問題点と開発目標
これまでの動物実験で,開口率23.6%のカバー薄膜で,留置後直後に確実に動脈瘤を塞栓しながら,留置後2~3ヶ月後に過度の内膜形成を抑制し内皮化が完了できた(6-7).さらに開口率を増やすことで更に早期内皮化完了が期待できるが,同時に塞栓性能の低下が懸念されていた.しかしながら,開口率と孔直径のいずれが塞栓治療性能に影響的であるのかなどは不明で,より論理的な仕様決定が求められていた.そこで本研究では,確実な動脈瘤の塞栓と早期の内膜化完了の両立を実現するために,流体力学に基づいたモデル実験と理論解析によって,ステント留置効果を定量評価した.開発目標は,これまでの動物実験の設定条件を超える開口率24%以上が条件となった.
3. 開発条件の設定
3.1 血管・瘤の形状と血流条件
過去の動物実験では,ビーグル犬の頸動脈やウサギの腕頭動脈に,自家静脈切片で作製したパッチを使って人為的に動脈瘤を作製していた事から,瘤や親血管の大きさや形状,心拍数,親血管形状,血流量,血液のヘマトクリット値等,実験条件を同一に設定することが難しく,またそれらの影響を系統的に調べ考察することは不可能であった.そこで力学的相似則に基づき,実験条件を選定することで問題の簡単化に務めた.条件設定の論理については既報(3)にて詳説しているため繰り返しは避けるが,例えば心拍数の影響については,留置対象となる親血管流れのReynolds数とWomersley数を求めることで整理した.実際に時間平均Reynolds数とWomersley数がステントを留置する脳血管部位と同じで代表的な脳血管である中大脳動脈の流量波形に近似させた拍動流を,瘤を持つ親血管モデルに流して可視化すると,図3のように流量の増減に関わらず瘤内の流脈線の乱れや変形はほとんど見られず,十分に準定常状態と見なせることが分かる.このように,一般的な力学的相似則に基づいて,現象の本質が捉えやすい状態まで問題を簡単化することで,定量評価し易くした.
 |
|
| (a) 定常流の場合(Re=750) | (b) 拍動流の場合(Re=660~870) |
| 図3 定常流,拍動流条件下における動脈瘤モデル内の流れの比較 | |
3.2 カバードステントモデル
生体外模擬実験に先立ち,過去の動物実験で使用したステントを直径6mmのアクリル製円管内に留置し,生体外において流れを可視化したが,図4のように金属製ステントストラットでシート光が遮られたり反射したりするため,流れの可視化が容易ではなく,また複雑なステントストラット形状に起因して僅かな留置位置の違いが流れ場に影響したり,模擬血管内にしっかりとステントを固定できない等の問題があったことから,簡易モデルを採用することとした.本カバードステントの個々の微細孔は,図1中のステントストラットの開口(図1写真中の<>部内)面積に比べると極めて小さいことから,カバードステント留置による血流抑止効果は微細孔が主であると考え,多孔薄膜だけを簡易的に再現した多孔薄板を用いた.これにより複雑なステント形状に由来する諸問題を細かく考慮する必要を無くした.
図4 プロトタイプステントをアクリル製円管に留置し可視化した例
3.3 生体外模擬実験
上述の条件設定などを元にして,単純化した2次元流体回路を作製し,レーザーシート法による流れの可視化観察およびそれを使った流れ場計測を行った.装置・手法の詳細は既報(3)を参照されたい.
4. カバードステント留置効果とその定量評価
4.1 瘤内流れの可視化
図5に,本研究で観察できた動脈瘤内の代表的なフローパターンの可視化画像を示す.本研究でも,先行研究(8)と同様に,薄膜を留置しなかった場合や,留置しても流れの抑制効果が低い場合は,瘤内全域にわたる大きな旋回流(8)が観察され,留置効果が大きいときに先の旋回流とは逆回転で非常にゆっくりとした半円状の旋回流れが観察できた.
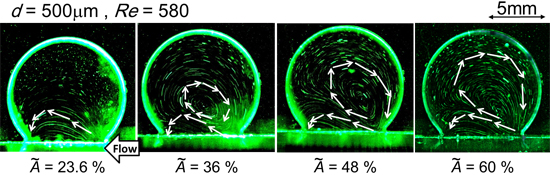
図5 親血管のレイノルズ数変化によって遷移する瘤内フローパターン例
4.2 ステント留置効果の定量評価
本研究が対象とする動脈瘤内の流れについては,動脈瘤の発生と成長や破裂を予測する研究が大半を占めており(1, 9-12など),どのような流れ状態になれば血栓が形成され塞栓治療できるのかという定量評価はほとんどなされていない.例えば,コイル塞栓術に用いられる電気離脱型コイル(GDC)やフローダイバーターステントと呼ばれる金属製円筒メッシュの留置効果の評価では,瘤内の血流速度や流量,運動エネルギー,渦度,循環,瘤壁面に作用するせん断応力などの流体力学的パラメータが留置前後でどの程度変化するのかを比率表示して性能を評価している場合が多い(13-16など)が,いくら流れ抑止効果が高くても,血栓形成に至らなければ治療にならないことから,評価指標として適切とは言い難い.
そこで本研究では,カバードステントによる瘤塞栓治療のメカニズムに立ち返り,血栓形成に注目した.血液中での血栓形成では,血球のせん断変形が重要な力学的刺激である (17).流れの停滞による血栓形成については,赤血球膜に存在するタンパク質であるエリスロエラスターゼ-IX(erythroelastase-IX) によって酵素による凝固第 IX 因子(factor IX)の活性化がトリガーとなる血液凝固反応が明らかになっており,これはせん断速度1s-1 以下のオーダーで起きると報告されている(18-20).本ステントの留置により瘤内の血流が澱み血球が低せん断に曝されることで第 IX 因子が活性化し血栓が形成すると考え,瘤内平均せん断速度を評価した.
その結果を図6に示す.比較のために同一流れ条件で薄膜留置前後のせん断速度の比を求めた結果も示しているが,本実験で使用した薄膜では,全条件で流れの抑制効果が強く,最も効果が弱い場合で留置前の1/10程度,強い場合で1/100程度とその効果に10倍程度の違いがあった.しかし瘤内平均せん断速度で評価すると,大きな直径の微細孔において閾値を超えることが確認できた.
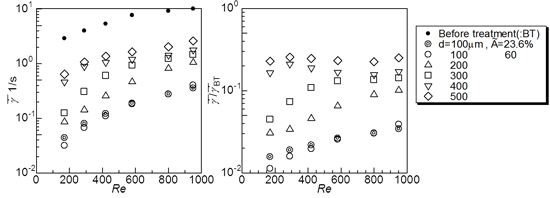
図6 動脈瘤モデル内平均せん断速度値とその留置前後でのせん断速度減少率の関係
4.3 ステント留置効果の理論解析
以上の生体外模擬実験の結果から,同一開口率でも孔直径が変わると瘤内フローパターンや平均せん断速度が異なること,また薄膜留置の効果が弱いときは親血管の壁面せん断応力による粘性力が瘤内血液を駆動していると考えられた事から,できるだけ簡単な力学理論を使い瘤内流れとステント留置効果の予測を試みた.
図7に示すように,親血管内の流れは円管内の十分に発達した層流と仮定し,Hagen-Poiseuilleの法則から求まる壁面せん断応力τwが,ネック部に親血管主流方向にn個列んだ孔直径dの微細孔開口を介して,瘤内血液が駆動され半径![]() の旋回運動をすると考える,駆動トルクTPVと,奥行きW の円柱状の2次元瘤モデル内に満たされた密度ρの血液塊の慣性モーメントIAの比は角運動量保存則より,
の旋回運動をすると考える,駆動トルクTPVと,奥行きW の円柱状の2次元瘤モデル内に満たされた密度ρの血液塊の慣性モーメントIAの比は角運動量保存則より,
| (1) |
と表される.血流の旋回半径は留置効果の違いにより変化するが,ここでは簡単化のため瘤内全域で流体塊が旋回運動すると仮定すると,旋回半径は瘤最大深さHa と瘤最大(赤道面)直径Da の算術平均の半値
| (2) |
で定義される瘤内腔平均半径で表すことができるため,式(1)は
| (3) |
と書ける.なおARとBFは,臨床で瘤の形態評価に用いられるアスペクト比とボトルネック係数である.ここでは粘性等によるエネルギー散逸は無視したが,角運動量保存則から求まる角加速度が大きいほど旋回流が強い事を意味する為,これを使い実験結果を整理した.
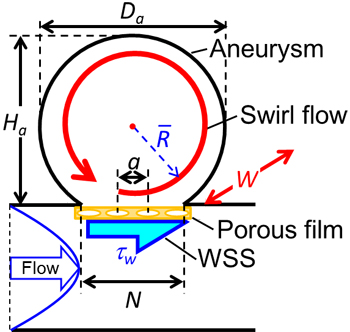
図7 理論解析に用いた親血管からの粘性力の伝達と瘤内旋回流の模式図
その結果,図8に示す各瘤内フローパターン時における瘤平均せん断速度可視化計測結果と本提案パラメータは線形な相関を示しており,留置効果の違いによるフローパターンの変化毎にそのトレンドが異なることが分かった.また,図9に開口毎に,微細孔径と親血管レイノルズ数に対して本指標の等高線を描いた結果を示すが,開口率が一定の場合本提案指標の等高線は孔直径とReynolds 数を漸近線とする双曲線状となり,実際に模擬実験で観察されたフローパターンマップの境界線形状とほぼ一致した.過去の動物実験では,微細孔径100μm,開口率12.6%と23.6%において,確実に動脈瘤を塞栓できた(6-7)ことや図7の結果から,本指標によって任意形状の動脈瘤に対する塞栓性能が予測でき,本ステントで瘤塞栓する場合は, Re<1000の親血管では,開口率60%の薄膜で塞栓が期待できる孔直径は100µm 以下,Re<700 で200µm以下であると考えられた.
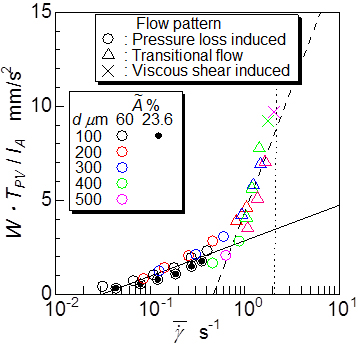
図8 角運動量保存則から求まる瘤内旋回流強さ予測指標と瘤内平均せん断速度の関係
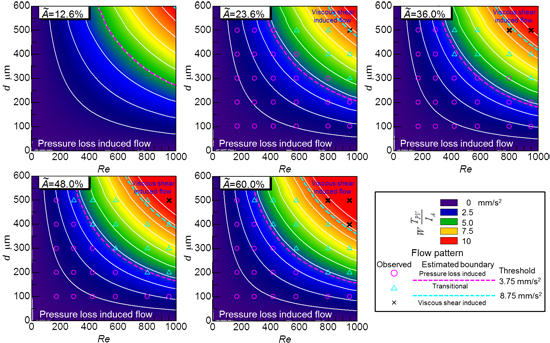
図9 瘤内旋回流強さ予測指標と生体外模擬実験で観察されたフローパターンの関係
さらに式(3)から瘤が大きいほど旋回流が遅くなることが示唆された.これは,本カバードステントが巨大な瘤や破裂の危険性が高いとされる大アスペクト比の瘤に対して,より治療効果が高まることを意味しており,一般的なコイル塞栓術では治療困難な巨大な動脈瘤を,親血管に留置するだけで簡便かつ即座に治療できる事が,理論的に証明できた.
4.4 動物実験による最適化設計の評価
以上が,既報(3)に記述された内容となるが,これら結果の有用性を確認するため,動物実験による評価を行った.前述の多孔薄膜の設計最適値を基にして,ステント拡張・留置時の微細孔径が約200µmと約600 µm,その時の開口率が約60%のカバードステントを試作し,ウサギの右腕頭動脈の総頸動脈分岐部に人為的に作製した動脈瘤直下にバルーンによって拡張・留置した.
留置前と微細孔径約200μmのステントを拡張・留置数分後の血管造影画像を図10に示す.画像の下側が近心側(カテーテル,ステント進入側),上側が遠心側であり,撮影速度は6fpsである.これらの結果より孔径600µmの場合は留置直後に塞栓されず瘤内に流れ込む造影剤が確認できたが,孔径200µmでは留置直後の瘤塞栓が確認できた.また,小さな瘤モデルは塞栓され難いことも確認しており,本研究で提案した理論解析の予測通りの結果が得られることが確認できた.
| (a) 留置前 | (b) 留置直後 |
| 図10 本研究によって予測された塞栓治療可能な開口率と孔直径が最大値 (d=200mm, |
|
4.5 今後の展望
実際の脳動脈瘤では,親血管は曲がりを有する3 次元形状であることから,その血流動態も2 次流れを伴う複雑な流れとなっている(21).今後, 2 次流れに伴い直接瘤内に入る流れに対する抑止効果について評価・予測する必要がある.
5 おわりに
以上,我々が開発・臨床応用を目指して開発している多孔薄膜カバードステントについて,紹介させて頂いた.本研究で採用した実験や解析理論は,非常に基本的なものを組み合わせただけに過ぎない.しかしながら,これによって極めて複雑なシステムである生体を使った実験を補完し,try and errorになりがちな動物実験が主体の医療機器の開発において,流体力学を始めとする機械工学がその一助になる可能性を示す事ができたと考える.
最初に述べた様に,現在我々は2015年度から開始予定のFIM(First-In-Man)試験,2018年の薬事承認申請を目指した開発の真っ只中にある.ちなみに,本ステントの開発では,これ以外にステントの柔軟性や構造的な耐久性の評価はもちろん,その他病床部位までステントを運搬するデリバリーカテーテルの開発等と薬事申請に必要な諸試験のデータ取得が同時並行で行われており,医師,企業,研究者,コーディネータ等が一体となって取り組んでいるが,このような医療機器開発の各場面において,本邦でも機械工学者の活躍の場が益々広がると考えられる.
謝 辞
なお本研究の一部は,厚生労働省 科学研究費補助金(23-実用化(臨床)-指定-003),日本学術振興会 科学研究費補助金(19700390),平成24 年度 関西大学大学院理工学研究科 高度化推進研究費,関西大学先端科学技術推進機構 平成24~26 年度「流体・弾性膜連成現象研究グループ」研究費によって行われた.
文 献


