流れ 2011年12月号 目次
― 特集テーマ: 医療と流体工学 ―
| リンク一覧にもどる | |
血管内治療支援のための大血管内腔可視化システムの開発
田中志信
本井幸介
山越憲一
大竹浩志
渡邊 剛
|
1.はじめに
動脈硬化など心血管系疾患の診断法,特に狭窄状態などの診断にはX線を利用した「血管造影法」や「冠動脈CT法」,核磁気共鳴を利用した「MRI法」,超音波を利用した「血管内超音波(Intravascular Ultrasound : IVUS)法」,近赤外光を利用した光干渉断層(Optical Coherence Tomography: OCT)法」など様々な方法用いられている[1].これらはいずれも血管の形状や狭窄の状態などを「イメージ像」として画像化するもので[2],侵襲性(身体を傷つける)の程度や画像解像度(空間分解能)の高低などそれぞれ一長一短があり[1],使用目的に応じて適宜モダリティの選択が行われている.
これら血管イメージング法に対して,極細径の内視鏡を血管内に挿入し病変部位を「直接目視観察」する方法として「血管内視鏡法」がある.この方法の特徴は,狭窄の原因である血管内壁の肥厚性病変の形状や色調を正確に観察できる点にあり治療方針の決定などに役立てられている[3].しかし観察のためには内視鏡周辺の血液を排除し無色透明の液体(生理食塩水:以下「生食」と略記)に置き換える必要があり,そのために「バルーン」[4]により一時的に血流を遮断しなければいけないという欠点がある.
一方,内径が20mm近い太い血管(例えば胸・腹部大動脈など)においてもやはり血管内腔を内視鏡により「直接目視・観察したい」という臨床的ニーズは高い.例えば大動脈瘤に対する低侵襲の予防的治療法として近年適用症例数が急増している「ステントグラフト内挿法」[5]では,挿入予定部位に細い分岐血管があるかどうか,さらには挿入位置の微調整など「血管内治療(手術)」の支援技術として「大血管内腔可視化技術」の開発が望まれている.しかしこれら大血管では心臓から絶え間なく拍出される血液を末梢に向かって常に送り出す必要があり,冠動脈などの細い動脈と違って例え短時間であっても血流を遮断(停止)することは許されない.そこで本研究ではこれらの課題を解決すべく「血流遮断することなく」大血管内腔を可視化可能な方法を新たに考案し実用化に向けた開発研究を行っている.以下,その概要について紹介する.
2.基本コンセプトとシステム概要
図1はこの目的を達成するために新たに考案した方法の概要である.収縮・拡張を繰り返す心臓の周期のうち,拡張期には大動脈内の血流量がほぼゼロとなることに着目し,この時期に同期して内視鏡先端部より生食を瞬時噴射し,この間に得た血管壁面の映像をキャプチャーし、繋ぎ合せることで連続した動画として可視化像を得るものである.
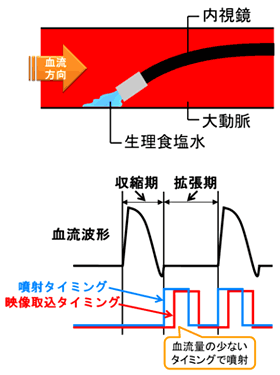
図1 大動脈可視化法原理説明図
図2はこのために新たに試作した大動脈内可視化用内視鏡の先端部構造を示したもので,基本的には首振り機能を有するファイバースコープ型直視鏡で生食噴射用チャネルの内径は1.7mmである.また前述したように将来的に「血管内治療(手術)」への適用を考えており,そのために種々の操作鉗子が挿入可能な「鉗子チャネル(内径2.0mm)」を併せ持つ構造としている.また、チップ先端部には血液遮蔽用のフード状部品(ヘモ・バイザーと呼称)を取り付け可能で,対物レンズと血管壁面間の生食滞留時間を延長させることで可視化性能の向上を図っている[6].
この内視鏡を用いて次のような「可視化システム」を構築した.即ち,生食を満たした圧力容器を圧縮空気によって加圧し(0.1~0.4MPa程度),高速電磁弁の開閉により生食の噴射制御を行う.噴射制御用のトリガ信号には心電R波または内蔵の発信器出力を選択可能で,内視鏡先端部のイメージガイドより得られた映像はプログラム処理無しの「リアルタイム映像表示」と,噴射時における可視化映像のみをキャプチャーして連続表示した「プログラム映像表示」の2種類がモニタ上に表示される.
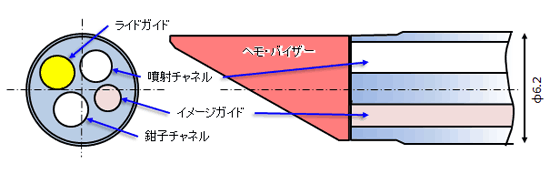
図2 試作内視鏡先端部構造概要
3.可視化性能評価実験
試作したシステムに対して,模擬循環回路を用いたin vitro試験および実験動物(ブタ)を用いたin vivo 試験により可視化性能評価を行った.
in vitro 実験システムは主に二つのユニット,即ち上述の「可視化システム」と生体の循環系を模擬した「模擬循環回路」から構成されている.ポンプ拍動数や流量,平均圧力,脈圧などの各種循環パラメータは成人男子安静時の生理的値に設定し,循環流体には血液の代替として白色懸濁液(炭酸水素ナトリウムを水道水に溶解したもの)を使用した.
観察対象のマーカーの設置場所は生体における大動脈内壁に相当する部分,即ち拍動ポンプ吐出口と密閉エアチャンバ(大動脈のコンプライアンスを模擬)間の配管(内径18mmのアクリルパイプ)内面に設置し(図3参照),次のような方法で可視化性能の定量評価を行った.予めアクリルパイプ内を水で満たし,この時のマーカー画像の白色部分及び黒線部分の輝度をそれぞれ255及び0に設定した.次に白色懸濁液を充填して可視化実験を行い,その時の白色部分と黒線部分との輝度差を求め可視化性能の評価指標とした.なお内視鏡手術を多数経験している外科医師の判断に基づき輝度差30以下を不鮮明領域とした.

図3 in vitro実験の観察部位
図4はin vitro 試験結果の一例で,ヘモ・バイザーを装着した状態で圧力容器内圧を0.1MPa, 電磁弁開放時間を200msとしたときの結果である.横軸は時間(ms)で拍動流ポンプの駆出開始時をゼロとして表示してある.縦軸は前述した輝度差で,シャドウ部分は輝度差が30以下の不鮮明領域である.パラメータは遅れ時間,即ちポンプ駆動開始から電磁弁が「開」となるまでの時間で50~550msの範囲で変化させている.この結果より拡張期の輝度差最大値は遅れ時間に依らず150程度の値が得られ,本システムが高い可視化性能を有していることが判る.
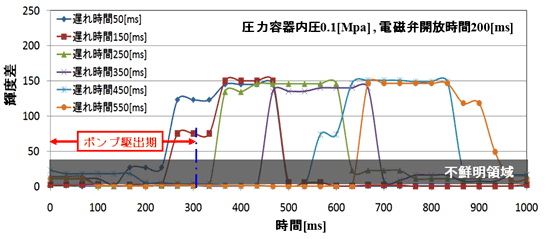
図4 in vitro 実験結果例
この様に可視化性能が高いことのメリットは「画質が良くなる」点にあるが,それ以上に重要なメリットがある.それは使用する生食の容量に関するものであり,可視化性能が良くなれば噴射時間を短くしたり、噴射回数を1心拍毎から2心拍毎に減らすことなどが可能となる.その結果,使用する生理食塩水の容量を減らすことができ,血液希釈や心臓に対する容量負荷などの危険性が軽減されるという非常に大きなメリットが生まれる.
最後にin vivo試験の結果について簡単に触れておく.実験動物は先に述べたとおり体重30kg程度のブタで,全身麻酔下に腹部大動脈より試作内視鏡を逆行性に挿入し,心電R波を噴射トリガとして胸部及び腹部大動脈内腔の可視化を試みた.その結果,大動脈弓部の分岐枝や下行大動脈内部に事前に吻合した人工血管の縫合部分などを明瞭に観察可能であることを確認している,図5左はin vivo試験時の内視鏡画像の一例で,腹部大動脈内に事前に挿入しておいたステントを観察したもので,白い滑らかな表面の血管壁と共にステントのエッジ部分が明瞭に観察できる.なお、黒色部分はヘモ・バイザーである.また、同図右は内視鏡の位置を検証するために撮影したアンギオ画像の例で,この図より内視鏡先端部が腹部大動脈内のステント留置位置まで到達していることが確認できる.
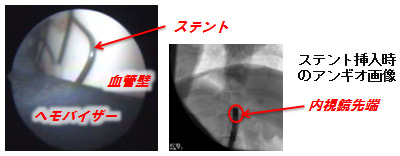
図5 in vivo試験時の内視鏡画像例(左)とその時の内視鏡位置を示すアンギオ画像(右)
以上示した試作システム,実験方法,実験結果等の詳細については文献[7-9]を参照されたい.
4.まとめ
以上,当研究室で開発している「大動脈内可視化システム」の概要について紹介した.動物実験の結果を見てもわかる通り,このシステムにより「生きた」実験動物の大動脈内部を「血流を止めることなく」観察可能で,本システムの有用性が臨床の場で評価され保険適用対象となれば量産化も進み,現在の消化器内視鏡のように心臓血管外科分野で普及することが期待できる.しかし問題は「製作コスト」で,今回試作した内視鏡(第1次プロト)は「特注品」であるため,その製作費は「高級国産車」が購入可能なほど高額である.そこで現在我々は本システムが臨床現場で広く利用されるよう「汎用性」を高めるべく,「低価格化」と「簡易構造化」への改良化研究を進めており,この目的に沿った「第2次プロト」の基本コンセプトもほぼ固まり予備実験を始めているところである.
今後の課題として、「実用化」と「事業化」があげられ、そのための「パートナー企業」の発掘が重要となる。本システムの有望性・将来性を見込んで技術的・資金的に支援いただける「ベンチャー精神に溢れる」企業が本稿をきっかけに現れることを祈念している.
なお本研究の一部は「文部科学省地域イノベーション戦略支援プログラム富山・石川地域ほくりく健康創造クラスター事業 ―医工融合による動脈硬化の診断と治療の先導的研究―」の補助により行われたものであり,ここに記して感謝の意を表する.
参考文献
| [1] | 高谷典秀,代田浩之,動脈硬化の画像診断,脈管学 Vol. 48, (2008),456-461 |
| [2] | 例えば下記「ボルケーノ・ジャパン株式会社ホームページ」で冠動脈用のIVUSカテーテル(センサ部外径:3.5Fr, 周波数:20MHz, 最大可視径:20mm)の外観と超音波画像例が閲覧可能 http://www.volcanojapan.com/products/ivus-imaging/ |
| [3] | 中村文隆,冠動脈血管内視鏡による診断と治療への応用,生体医工学,Vol.43, No.1, (2005), 8-11 |
| [4] | 例えば下記「ファイバーテック株式会社ホームページ」でバルーン付き血管内視鏡(ベックムーバNEO,シャフト径:4.5Fr,ファイバー数:3000)の外観が閲覧可能http://www.fibertech.jp/m1_1_2.html |
| [5] | 例えば下記「日本メドトロニック株式会社ホームページ」で胸部大動脈瘤に対する挿入例やステントグラフト外観が閲覧可能http://www.mdtendovascular.com/thoracicaorta/endovascular_stent.html |
| [6] | 山越憲一,田中志信,内視鏡およびそれを用いた血管内視鏡システム,特願2009-245717 |
| [7] | S. Tanaka, K. Tokugi, M. Ogawa, K. Motoi, M. Nogawa, H. Ohtake, G. Watanabe and K. Yamakoshi, Development of a New Vascular Endoscopic System for Observing Inner Wall of Aorta Using Intermittent Saline Jet, WC 2009, IFMBE Proc., vol. 25/VI, (2009)217-219 |
| [8] | S. Tanaka, K. Tokugi, M. Ogawa, K. Motoi, M. Nogawa, H. Ohtake, G. Watanabe and K. Yamakoshi,, Development of a vascular endoscopic system for observing inner wall of large arteries for the use of endovascular intervention, Proc.ITAB2010 (CD-ROM), IEEE Catalog Number: CFP10ITA-ART, paper No.123, (2010) |
| [9] | S. Tanaka, T. Suzuki, M. Ogawa, K. Motoi, M. Nogawa, H. Ohtake, G. Watanabe and K. Yamakoshi, Evaluation of a Newly Designed Endoscope for Observing Inner Wall of Large Arteries for the Use of Endovascular Intervention, Proc.33rd Intl. Conf. IEEE EMBS, (2011), 345-348 |






